Innehåll
-
proteoglykaner
Proteoglykaner är proteiner som är starkt glykosylerade. Den grundläggande proteoglycanenheten består av ett "kärnprotein" med en eller flera kovalent bundna glykosaminoglykan (GAG) -kedjor. Fästpunkten är en serin (Ser) rest till vilken glykosaminoglykan är förenad genom en tetrasackaridbrygga (t.ex. chondroitinsulfat-GlcA-Gal-Gal-Xyl-PROTEIN). Ser-resten finns generellt i sekvensen -Ser-Gly-X-Gly- (där X kan vara vilken aminosyrarest som helst men prolin), även om inte alla proteiner med denna sekvens har en bifogad glykosaminoglykan. Kedjorna är långa, linjära kolhydratpolymerer som är negativt laddade under fysiologiska förhållanden på grund av förekomsten av sulfat- och uronsyragrupper. Proteoglykaner förekommer i bindvävnaden.
-
glykoprotein
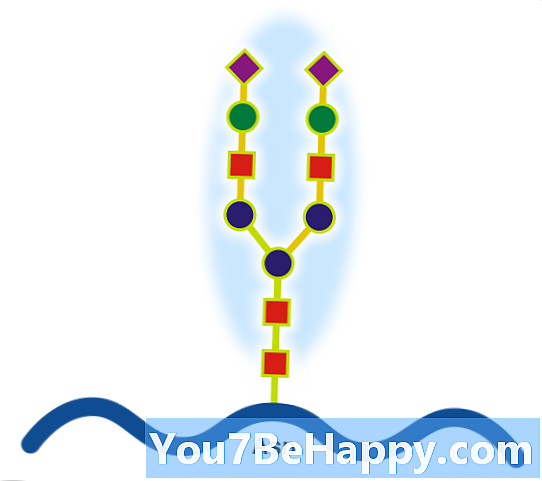
Glykoproteiner är proteiner som innehåller oligosackaridkedjor (glykaner) kovalent bundna till aminosyrasidokedjor. Kolhydratet är bundet till proteinet i en cotranslational eller posttranslational modifiering. Denna process kallas glykosylering. Utsöndrade extracellulära proteiner glykosyleras ofta. I proteiner som har segment som sträcker sig extracellulärt är de extracellulära segmenten ofta glykosylerade. Glykoproteiner är också ofta viktiga integrerade membranproteiner, där de spelar en roll i cell-cell-interaktioner. Det är viktigt att särskilja endoplasmatisk retikulumbaserad glykosylering av det sekretoriska systemet från reversibel cytosolisk-nukleär glykosylering. Glykoproteiner i cytosolen och kärnan kan modifieras genom den reversibla tillsatsen av en enda GlcNAc-rest som anses vara ömsesidig till fosforylering och funktionerna hos dessa är troligtvis en ytterligare regleringsmekanism som styr fosforyleringsbaserad signalering. Däremot kan klassisk sekretorisk glykosylering vara strukturellt nödvändig. Exempelvis kan hämning av asparaginbunden, dvs N-kopplad, glykosylering förhindra korrekt glykoproteinvikning och full hämning kan vara toxisk för en individuell cell. Däremot kan störning av glykanbehandling (enzymatisk borttagning / tillsats av kolhydratrester till glykan), som förekommer i både den endoplastiska retikulum och Golgi-apparaten, fördelas för isolerade celler (som bevis för överlevnad med glykosidinhibitorer) men kan leda till människor sjukdom (medfödda sjukdomar i glykosylering) och kan vara dödliga i djurmodeller. Det är därför troligt att finbearbetningen av glykaner är viktig för endogen funktionalitet, såsom cellhandel, men att detta troligen har varit sekundärt till dess roll i värd-patogen-interaktioner. Ett känt exempel på denna senare effekt är ABO-blodgruppssystemet.
Proteoglycans (substantiv)
flertal av proteoglycan
Glycoprotein (substantiv)
Ett protein med kovalent bundna kolhydrater.
Glycoprotein (substantiv)
vilken som helst av en klass av proteiner som har kolhydratgrupper bundna till polypeptidkedjan.
Glycoprotein (substantiv)
ett konjugerat protein med en kolhydratkomponent